医疗器械主文档登记的定义
医疗器械主文档登记是指主文档所有者将与医疗器械相关的技术资料等提交给医疗器械技术审评机构进行存档管理的过程。这些资料可授权医疗器械注册申请人在申报医疗器械注册等事项时引用,作为注册申报资料的一部分,而技术审评机构不会向注册申请人披露主文档资料内容。
医疗器械主文档登记的目的
提高审评审批质量与效率
避免重复工作:
防止不同医疗器械注册申请人为相同的原材料、关键元器件等技术资料重复提交,审评机构可集中对主文档进行一次审阅,减少重复劳动,从而有更多精力深入评估产品的关键技术和风险点,提高审评审批质量。
规范审评流程:
为审评工作提供统一、规范的参考依据,使审评过程更加标准化、科学化,减少因资料提交不一致等问题导致的审评差异,有助于建立更加科学高效的审评审批体系。
鼓励创新
降低创新成本:
对于创新型医疗器械企业,主文档登记使得他们在选择新型原材料或关键元器件时,无需花费大量时间和精力去重复研究和提交已有的基础资料,降低了研发和注册成本,从而可以将更多资源投入到创新研发中,加快创新产品的上市速度。
促进技术交流:
主文档的存在便于创新企业了解行业内先进的原材料和元器件技术,为创新提供更多思路和资源,同时也有利于整个行业的技术交流与共享,推动医疗器械行业的创新发展。
方便企业选材与简化申报
丰富选材信息:
医疗器械生产企业可以通过主文档了解到更多种类的原材料和关键元器件信息,拓宽选材渠道,有助于选择更适合产品需求、性能更优的材料和部件,提高产品质量和性能。
简化注册流程:
企业在注册申报时,只需引用相关主文档,无需重复提交详细的原材料等资料,大大简化了注册申报流程,缩短了注册周期,提高了企业的注册效率,使企业能够更快地将产品推向市场。
保护商业秘密
保障企业权益:
对于原材料供应商等第三方企业,他们可以将技术资料以主文档形式提交给监管机构,在满足监管要求的同时,避免了将敏感的商业秘密信息直接披露给医疗器械注册申请人,保护了自身的知识产权和商业利益,有利于维护市场公平竞争。
增强行业信任:
这种保护机制有助于增强企业间的信任,促进产业链上下游企业之间的合作,使得整个医疗器械产业供应链更加稳定和高效。
医疗器械主文档登记的关键事项
法规依据:
主要依据《医疗器械注册管理办法》《体外诊断试剂注册管理办法》等法规文件,这些法规为医疗器械主文档登记工作提供了法律支撑和规范标准,确保登记工作在合法合规的框架内进行。
适用范围:
-
进口二类医疗器械
-
进口三类医疗器械
-
境内三类医疗器械(包括体外诊断试剂)注册、变更、临床试验审批等申请事项中引用主文档。
-
各省、自治区、直辖市药品监督管理局可根据实际情况参照《国家药监局关于医疗器械主文档登记事项的公告(2021年第36号)》开展境内第二类医疗器械主文档登记事项。
基本原则:
-
自愿原则:主文档由其所有者自愿提交登记申请。
-
保密原则:监管机构对主文档所有者的技术资料进行保密审阅,不向医疗器械注册申请人披露主文档资料内容。
-
避免重复原则:防止不同医疗器械注册申请人为相同内容重复提交资料,减少不必要的工作。
境外主文档所有者需在境内设代理机构,明确其信息和委托权限,便于沟通、资料更新和授权引用。
主文档内容:
内容涉及医疗器械多方面,如原材料主文档包含成分、性能、生物学评价等资料。但部分特定内容不适合用主文档提交,如体外诊断试剂原材料信息。提交形式为电子文档,技术内容参照注册申报要求及指导原则。
主文档更新:
所有者可更新主文档,包括授权、代理机构和资料变化等情况。更新时需提交全套更新资料及变化说明。主文档内容变化可能影响医疗器械,所有者有义务提前告知注册人,注册人据此评估影响并采取措施,必要时进行注册变更。
主文档授权:
注册申请人引用已登记主文档需获所有者或代理机构书面授权。授权书应包含企业名称、产品名称等关键信息,由所有者签章。授权书直接给申请人,原件附在注册申报资料中,申请受理后授权不可撤销。补正资料涉及主文档更新时,所有者需更新主文档并出具新授权书 。
形式要求:
①登记资料完整齐备。
②各项文件除登记资料外均需以中文形式提供。
③主文档登记资料如无特殊说明的,需由主文档所有者签章。主文档登记资料以电子形式提交,相关要求可参见《关于实施医疗器械注册电子申报的公告》(国家药品监督管理局2019年第46号)及《关于发布医疗器械注册申请电子提交技术指南的通告》(国家药品监督管理局2019年第29号)。
④代理机构委托书的内容需包括:办理医疗器械主文档登记申请;承担与国家药品监督管理部门、进口主文档所有者的沟通联络;向进口主文档所有者如实、准确传达相关的法规和技术要求;对主文档内容进行更新。代理机构的承诺书由代理机构相关负责人签章,其内容需与委托书中委托的事宜一致。
⑤登记资料需具有所提交资料的目录,包括整个申报资料的1级和2级标题,并以表格形式说明每项的卷和页码。
⑥主文档所有者和代理机构需分别对各自提交的文件出具真实性声明。
医疗器械主文档登记的关键事项
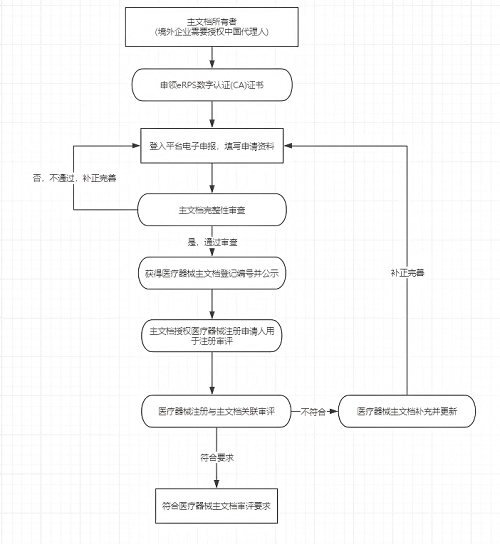
主文档所有者可通过医疗器械审评中心的登记平台按要求提交主文档登记资料,登记后获得主文档登记编号,主文档授权医疗器械注册申请人用于注册审评时,审评机构进行关联审评。
医疗器械主文档登记流程